3 基本信息
ICS 11.020
C 59
中华人民共和国卫生行业标准WS 269—2019《布鲁氏菌病诊断》(Diagnosis for brucellosis)由中华人民共和国国家卫生健康委员会于2019年01月02日发布,自2019年07月01日《关于发布〈淋病诊断〉等4项强制性卫生行业标准的通告》(国卫通〔2019〕1号)起实施。本标准代替 WS 269—2007。
4 发布通知
国卫通〔2019〕1号
现发布《淋病诊断》等4项强制性卫生行业标准,编号和名称如下:
WS 268—2019 淋病诊断(代替WS 268—2007 )
WS 269—2019 布鲁氏菌病诊断(代替WS 269—2007 )
WS 293—2019 艾滋病和艾滋病病毒感染诊断(代替WS 293—2008 )
WS 295—2019 流行性脑脊髓膜炎诊断(代替WS 295—2008)
上述标准自2019年7月1日起施行,WS 268—2007、WS 269—2007、WS 293—2008、WS 295—2008 同时废止。
特此通告。
国家卫生健康委员会
2019年1月2日
5 前言
本标准第6章为强制性条款,其余为推荐性条款。
本标准按照 GB/T 1.1—2009 给出的规则起草。
本标准代替 WS 269—2007《布鲁氏菌病诊断标准》。
本标准与 WS 269—2007 相比,主要技术变化如下:
——增加了规范性引用文件(见第2章);
——增加了缩略语(见第3章);
——增加了胶体金免疫层析试验(见4.3.1.2、附录C.2);
——增加了酶联免疫吸附试验(见4.3.1.3、附录C.3);
——增加了布鲁氏菌培养物涂片革兰染色检出疑似布鲁氏菌(见4.3.1.4);
——修订了诊断原则,增加了临床诊断(见第5章和6.2);
——增加了布鲁氏菌的培养,血培养仪培养布鲁氏菌的方法(见D.1和D.1.1);
——修订了布鲁氏菌的培养中双相血培养瓶培养布鲁氏菌方法(见D.1.2);
——修订了布鲁氏菌的培养中病理材料培养布鲁氏菌培养方法(见D.1.3);
——增加了布鲁氏菌的核酸检测及BCSP31聚合酶链式反应(见D.2.5和D.2.5.1);
——增加了AMOS聚合酶链式反应(见D.2.5.2);
——增加了布鲁氏菌基因组DNA提取操作方法(见D.2.6);
——增加了布鲁氏菌实验生物安全要求(见 D.3);
——删除了平板凝集试验(PAT)(见2007年版的C.1.1);
——删除了皮肤过敏试验(见2007年版的C.2);
——删除了布鲁氏菌培养的接种未受精鸡卵法(见2007年版的C.3.1.2);
——删除了布鲁氏菌培养的尿液培养法(见2007年版的C.3.2);
——删除了血培养的生物学分离布氏菌法(见2007年版的C.3.4)。
本标准起草单位:中国疾病预防控制中心传染病预防控制所、北京地坛医院、中国疾病预防控制中心鼠疫布氏菌病预防控制基地、山西省疾病预防控制中心、辽宁省疾病预防控制中心、湖北省疾病预防控制中心、内蒙古自治区综合疾病预防控制中心、杭州市疾病预防控制中心、青海省地方病预防控制所。
本标准主要起草人:崔步云、李兴旺、王大力、姜海、张秋香、毛玲玲、程均福、米景川、徐卫民、徐立青、田国忠、刘熹。
本标准所代替标准的历次版本发布情况为:
——WS 269—2007。
6 标准正文
布鲁氏菌病诊断
6.1 1 范围
本标准规定了人间布鲁氏菌病的诊断依据、诊断原则、诊断和鉴别诊断。
本标准适用于全国各级各类医疗卫生机构及其医务人员对布鲁氏菌病的诊断。
6.2 2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定 卫生部令第45号 2005年
人间传染的病原微生物名录 卫生部(卫科教发〔2006〕15号)
危险品航空安全运输技术细则 国际民航组织(Doc 9284号文件)
6.3 3 缩略语
下列缩略语适用于本文件。
CFT:补体结合试验(complement fixation test)
DNA:脱氧核糖核酸(deoxyribonucleic acid)
dNTPs:脱氧核苷三磷酸(deoxy-ribonucleoside triphosphate)
ELISA:酶联免疫吸附试验(enzyme linked immunosorbent assay)
GICA:胶体金免疫层析试验(gold immunochromatography assay)
PBS:磷酸盐缓冲液(phosphate buffer saline)
PCR:聚合酶链式反应(polymerase chain reaction)
RBT:虎红平板凝集试验(rose bengal plate agglutination test)
RTD:常规试验稀释度(routine test dilution)
SAT:试管凝集试验(serum agglutination test)
6.4 4 诊断依据
6.4.1 4.1 流行病学史
发病前病人与疑似布鲁氏菌感染的家畜、畜产品有密切接触史,或生食过牛、羊乳及肉制品,或生活在布鲁氏菌病疫区;或从事布鲁氏菌培养、检测或布鲁氏菌疫苗生产、使用等工作。其他流行病学参见附录 A。
6.4.2 4.2 临床表现
4.2.1 出现持续数日乃至数周发热(包括低热),多汗,乏力,肌肉和关节疼痛等。
4.2.2 部分患者淋巴结、肝、脾和睾丸肿大,少数患者可出现各种各样的皮疹和黄疸;急慢性期患者可以表现为骨关节系统损害。具体临床表现参见附录 B。
6.4.3 4.3 实验室检查(实验方法见附录 C、附录 D)
6.4.3.1 4.3.1 实验室初筛
4.3.1.4 布鲁氏菌培养物涂片革兰染色检出疑似布鲁氏菌。
6.4.3.2 4.3.2 实验室确诊
4.3.2.1 从病人血液、骨髓、其他体液及排泄物等任一种病理材料培养物中分离到布鲁氏菌。
4.3.2.2 试管凝集试验(SAT)滴度为 1:100++及以上,或者患者病程持续一年以上且仍有临床症状者滴度为 1:50++及以上。
4.3.2.3 补体结合试验(CFT)滴度为 1:10++及以上。
4.3.2.4 抗人免疫球蛋白试验(Coomb’s)滴度为 1:400++及以上。
6.5 5 诊断原则
布鲁氏菌病的发生、发展和转归比较复杂,其临床表现多种多样,很难以某一种症状来确定诊断。对布鲁氏菌病的诊断,应结合病人流行病学接触史、临床表现和实验室检查等情况综合判断。
6.6 6 诊断
6.6.1 6.1 疑似病例
符合4.1,并同时符合4.2。
6.6.2 6.2 临床诊断病例
符合疑似病例并同时符合4.3.1中任一项。
6.6.3 6.3 确诊病例
符合疑似或临床诊断病例并同时符合4.3.2中任一项。
6.6.4 6.4 隐性感染
符合4.1,并同时符合4.3.2中任一项,且不符合4.2。
6.7 7 鉴别诊断
7 附录A(资料性附录)布鲁氏菌病流行病学
7.1 A.1 布鲁氏菌病
布鲁氏菌病是由布鲁氏菌属的细菌侵入机体,引起的人兽共患的传染-变态反应性疾病。
7.2 A.2 贮存宿主及传染源
布鲁氏菌的贮存宿主很多,已知有60多种动物(家畜、家禽、野生动物、驯化动物)可以作为布鲁氏菌贮存宿主。布鲁氏菌病往往先在家畜或野生动物中传播,随后波及人类,是人畜共患的传染病。疫畜是布鲁氏菌病的主要传染源,我国大部分地区以羊作为主要传染源,有些地方牛是传染源,南方个别省份的猪可作为传染源。鹿和犬等经济动物也可成为传染源。
7.3 A.3 传播途径及传播因子
病原体可以通过体表皮肤黏膜、消化道、呼吸道侵入机体。人的感染途径与职业、饮食、生活习惯有关。
含有布鲁氏菌的各种污染物及食物均可成为传播媒介,主要有病畜流产物、病畜的乳、肉、内脏,被布鲁氏菌污染的皮毛、水、土壤、尘埃等。
7.4 A.4 易感人群
人类对布鲁氏菌普遍易感。人群布鲁氏菌病感染率与传染源和传播媒介密切接触的机会、程度有关。布鲁氏菌病患者可以重复感染布鲁氏菌。
7.5 A.5 分布
7.5.1 A.5.1 职业
有明显的职业性,凡与病畜、染菌畜产品接触多者发病率高。农民、牧民、兽医、皮毛和乳、肉加工人员及相关实验人员感染率比一般人高。
7.5.2 A.5.2 性别
人对布鲁氏菌易感,无性别差异,主要取决于接触机会多少。
7.5.3 A.5.3 年龄
各年龄组均可感染发病。由于青壮年是主要劳动力,接触病畜频繁,因而感染率比其他年龄组高。
7.5.4 A.5.4 季节
一年四季各月均可发病。羊种布鲁氏菌流行区有明显的季节性高峰。我国北方农牧区人群发病高峰在4月~5月,夏季剪羊毛和乳肉食品增多,也可出现一个小的发病高峰。牛种、猪种布鲁氏菌的布鲁氏菌病季节性不明显。
7.5.5 A.5.5 地区
布鲁氏菌病感染率在农牧区高于城镇,农牧区人与家畜接触频繁,感染机会多,城市病人则多集中在一些皮毛乳肉加工企业。
7.6 A.6 不同疫区的流行特点
7.6.1 A.6.1 羊种布鲁氏菌疫区
羊种布鲁氏菌疫区的主要传染源是病羊。羊种布鲁氏菌1、2、3生物型对人、畜均有较强的侵袭力和致病力,易引起人、畜间布鲁氏菌病暴发流行,疫情重。大多出现典型的临床症状和体征。
7.6.2 A.6.2 牛种布鲁氏菌疫区
牛种布鲁氏菌疫区的主要传染源是病牛。牛种布鲁氏菌生物型较多,毒力不一。就总体而言,牛种布鲁氏菌毒力较弱,但有较强的侵袭力,即使是弱毒株,也可使牛发生暴发性流产或不孕,严重影响畜牧业发展。但对人致病较轻,感染率高而发病率低,呈散发性。临床症状和体征多不典型,病程短,后遗症较少。
7.6.3 A.6.3 猪种布鲁氏菌疫区
猪种布鲁氏菌疫区主要传染源是病猪。通常由猪种1型和猪种3型布鲁氏菌致病,毒力介于羊种布鲁氏菌和牛种布鲁氏菌之间。同一生物型菌株,既有强毒株,也有弱毒株。猪种布鲁氏菌对猪致病力强,对羊、牛致病力较弱。对人致病力比牛种布鲁氏菌强,除少数病例病情较重外,大多数无急性期临床表现。
7.6.4 A.6.4 犬种布鲁氏菌疫区
犬种布鲁氏菌疫区主要传染源是病犬。犬种布鲁氏菌除了侵袭犬,引起犬流产外,也可使猫、牛、猪、兔、梅花鹿、鼠等动物感染,产生抗犬种布鲁氏菌抗体。人也可被感染,鲜有发病。
7.6.5 A.6.5 混合型布鲁氏菌疫区
2种或2种以上布鲁氏菌同时在一个疫区存在,这与羊、牛同在一个牧场放牧或圈舍邻近有关。由于彼此接触密切,不同菌种可以发生转移,从羊种布鲁氏菌转移到牛多见,也有羊种布鲁氏菌转移到猪;猪种、牛种布鲁氏菌也可转移到羊。混合型疫区流行特点取决于当地存在的主要菌种。
8 附录B(资料性附录)布鲁氏菌病临床表现
8.1 B.1 主要症状
8.1.1 B.1.1 发热
是布鲁氏菌病常见的临床表现,典型病例表现为波状热,常伴有寒战等症状,可见于各期患者。部分病例可表现为低热和不规则热型,且多发生在午后或夜间。
布鲁氏菌病患者在高热时神志清醒,痛苦较小,但体温下降时自觉症状加重,这种高热与病况相矛盾的现象为布鲁氏菌病所特有。
8.1.2 B.1.2 多汗
是布鲁氏菌病常见的临床表现,急性期病例出汗尤重,体温下降时加重,可湿透衣裤、被褥,使患者感到紧张和烦躁。
8.1.3 B.1.3 肌肉和关节疼痛
是布鲁氏菌病常见的临床表现,为全身肌肉和多发性、游走性大关节疼痛。一些病例还可有脊柱(腰椎为主)骨关节受累,表现为疼痛、畸形和功能障碍等。
8.1.4 B.1.4 乏力
几乎全部病例都有乏力疲劳的表现。
8.1.5 B.1.5 其他
8.2 B.2 主要体征
8.2.1 B.2.1 肝、脾及淋巴结肿大
多见于急性期病例,肝、脾肿大的患者恢复较慢。
8.2.2 B.2.2 其他
男性病例可伴有睾丸炎,女性病例可见卵巢炎。急性期患者可以出现各种各样的皮疹,一些患者可以出现黄疸,慢性期患者表现为骨关节系统的损害。
8.3 B.3 临床分期
8.3.1 B.3.1 急性期
具有上述临床表现,病程在3个月以内,出现确诊的血清学阳性反应。
8.3.2 B.3.2 亚急性期
具有上述临床表现,病程在3个月~6个月之间,出现确诊的血清学阳性反应。
8.3.3 B.3.3 慢性期
病程超过6个月仍未痊愈,有布鲁氏菌病的症状和体征,并出现确诊的血清学阳性反应。
8.4 B.4 潜伏期
9 附录C(规范性附录)
9.1 C.1 虎红平板凝集试验(RBT)
9.1.1 C.1.1 器材与试剂
C.1.1.1 器材:清洁玻片、微量加样器、木签、计时器。
C.1.1.2 试剂:虎红平板凝集抗原、已知的阴性和阳性血清、待检血清。
9.1.2 C.1.2 操作方法
在玻片上加30 μL待检血清,然后加入虎红平板凝集抗原30 μL,摇匀或用木签充分混匀,在5 min内观察结果。每批次实验同时用阴性、阳性血清各一份作对照。
9.1.3 C.1.3 结果判定
出现肉眼可见的凝集反应判为阳性;液体均匀混浊、未见到凝集反应判为阴性。
9.2 C.2 胶体金免疫层析试验(GICA)
9.2.1 C.2.1 器材及试剂
C.2.1.1 器材:测试卡包被可溶性布鲁氏菌菌体抗原、人IgG的硝酸纤维素膜和胶体金标记结合物。0.1mL吸管或微量加样器。
9.2.2 C.2.2 操作方法
在测试卡加样孔内加入10 μL待检血清,待渗入。
在加样孔内加入生理盐水100 μL,待渗入。3 min~20 min 内观察结果。
9.2.3 C.2.3 结果判定
测试卡质控区(C)显示红色线条,为此试验结果可信;未显示红色线条,此次试验失败。
测试区(T)显示红色线条,试验结果为阳性,只有质控区出现一条红色线条为阴性。
注:胶体金免疫层析试验可能有不同测试卡,实验方法可能有差别,具体实验参照介绍检测和作出实验诊断。
9.3 C.3 酶联免疫吸附试验(ELISA)
9.3.1 C.3.1 试剂盒及器材
9.3.1.1 C.3.1.1 试剂盒组成
试剂盒组成详见表C.1。
表C.1 ELISA 试剂盒组成
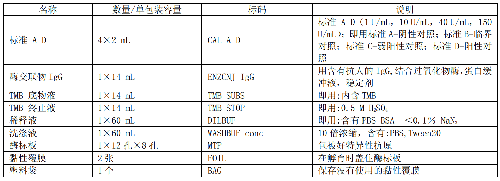
9.3.1.2 C.3.1.2 器材
酶标仪(吸收波长450 nm,参考波长600 nm~650 nm)、洗板机、移液器、8道移液器、1 mL移液管、计时器、吸水纸巾、吸头、稀释板、加样槽、记号笔、双蒸馏水或去离子水。
9.3.1.3 C.3.1.3 检测前准备
按照介绍配制洗涤液、稀释液。
按照介绍稀释待检血清。
9.3.2 C.3.2 操作方法
步骤如下:
a) 吸取 100 μL 的各阴阳性对照液和稀释的样品,分别加入到相应酶标板孔中。
b) 用黏性覆膜盖住酶标板,在 18 ℃~25 ℃孵育 60 min。
c) 移去覆膜,弃去酶标板液体。每孔加入稀释好的稀释液 300 μL,洗板 3 次,将板倒置在纸巾上除去剩余液体。
d) 使用移液器加入 100 μL 酶交联物;取新的覆膜盖住酶标板,在 18 ℃~25 ℃孵育 30 min;
e) 重复 C.3.2.c)。
f) 使用移液器加底物液和终止液,加底物液和终止液的间隔时间应一样,加样时应避免产生气泡。
g) 每孔加 100 μL 的 TMB 底物液,取新的黏性覆膜盖住酶标板,在 18 ℃~25 ℃孵育 20 min 后,每孔加入 100 μL TMB 终止液终止酶促反应,轻荡酶标板使其混匀,颜色由蓝变黄为止。
h) 在加入终止液的 60 min 内,在 450 nm 处检测吸光度。
9.3.3 C.3.3 质量控制
C.3.3.1 阴性、阳性标准品的OD值在质控要求的范围内。
C.3.3.2 试验用仪器、加样器必需经过严格的校验或标定。
C.3.3.3 试剂应在规定的储存条件下存储,在有效期内使用。
9.3.4 C.3.4 结果判定
参照介绍使用酶标仪读取样品的OD值。以标准的OD值为y轴,标准品的浓度为x轴,在对数坐标纸上做一条标准曲线。然后在曲线上读取相应样品的浓度值。结果判定情况如下:
a) >12 U/mL 为实验阳性;
b) 8 U/mL~12 U/mL 为实验可疑;
c) <8 U/mL 为实验阴性。
酶联免疫吸附试验可以检测IgM(IgM-ELISA)、IgG(IgG-ELISA)等免疫球蛋白,实验原理、方法可能有差别,具体实验参照试剂盒介绍检测和作出实验诊断。
9.4 C.4 试管凝集试验(SAT)
9.4.1 C.4.1 器材及试剂
试管凝集抗原、已知的阴性和阳性血清、待检血清、生理盐水、1 mL吸管、血清凝集试管、试管架、37℃温箱等。
9.4.2 C.4.2 操作方法
步骤如下:
a) 待检血清的稀释。在一般情况下,每份血清用 5 支试管,第一管加入 2.3 mL 生理盐水,第二管不加,第三、四、五管各加 0.5 mL。用吸管吸取待检血清 0.2 mL 加入第一只试管中,混匀。混匀后,以吸管吸取第一管中血清加入第二和第三管各 0.5 mL,以吸管将第三管混匀,并吸0.5 mL 加入第四管,混匀。从第四管吸取 0.5 mL 加入第五管,混匀。再从第五管吸取 0.5 mL弃去。如此稀释后,从第二管到第五管血清稀释度分别为 1:12.5、1:25、1:50 和 1:100。
b) 加入抗原。先以生理盐水将抗原原液作适当稀释成抗原应用液(按照介绍操作,一般作 1:10稀释),稀释后的抗原应用液加入各稀释的血清管(第一管不加,作为血清对照),每管加0.5 mL,混匀。加入抗原应用液后第二管至第五管,每管总量 1 mL,血清稀释度从第二管到第五管分别为 1:25、1:50、1:100 和 1:200。从第一管再吸出 0.5 mL 弃去,剩 1 mL。
c) 对照。阴性血清对照,血清稀释后加抗原应用液(与待检血清对照相似);阳性血清对照,其血清稀释到原有滴度,再加抗原应用液;抗原对照,适当稀释的抗原加生理盐水。
9.4.3 C.4.3 结果判定
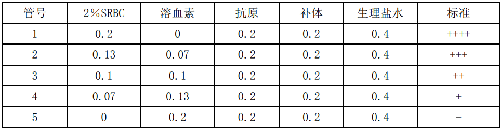
C.4.3.1 制备参照比浊管:每次试验须配置参照比浊管作为判定的依据。配置方法是:取试验用抗原液,加入生理盐水稀释成抗原应用液,按表C.2配置比浊管。
表C.2 试管凝集试验判定比浊管配制
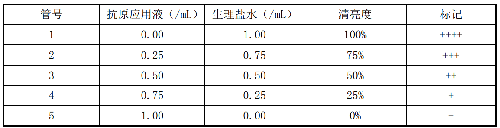
C.4.3.2 判定结果:全部试验管,对照管及参照比浊管充分振荡后置37 ℃温箱中反应20 h~22 h,取出后放室温2 h,然后参照比浊管为标准判定结果。
C.4.3.3 记录结果:根据各管中上层液体的清亮度记录结果。特别是50%清亮度(++)对判定结果关系较大,一定要与比浊管对比判定。
++++:完全凝集,上层液100%清亮。
+++:几乎完全凝集,上层液75%清亮。
++:显著凝集,液体50%清亮。
+:有微量凝集,液体25%清亮。
-:无凝集,液体不清亮。
确定每份血清滴度是以出现“++”及以上的凝集现象的最高血清稀释度。
注:为了获得待检标本的最终阳性滴度效价,可以参考其他试验结果,增加更多的稀释度。
9.5 C.5 补体结合试验(CFT)
9.5.1 C.5.1 试剂及器材
C.5.1.1 试剂:生理盐水、补体(豚鼠血清或冻干补体)、2%绵羊红细胞悬液、溶血素、布鲁氏菌补体结合抗原、阴性和阳性血清、被检血清。
C.5.1.2 器材:37 ℃水浴箱、普通离心机、普通冰箱、0.1 mL、1 mL和10 mL吸管、血清凝集管和试管架。
9.5.2 C.5.2 五种成分的处理和滴定
9.5.2.1 C.5.2.1 补体
真空干燥补体可保持较长时间活性。亦可以选取数只健康豚鼠,取血分离血清,混合血清后即为所需补体。在CFT试验前需要进行补体滴定,确定试验用的补体稀释度。滴定步骤参照表C.3,如下操作:
a) 将补体稀释为1:20,在10支凝集管中分别依次加入不同量的1:20补体稀释液0.02 mL~0.2mL;
b) 各管加 2 个单位的抗原液 0.2 mL;
c) 用生理盐水把各管补至 0.6 mL;
d) 混匀后放 37 ℃水浴 30 min;
e) 加 0.2 mL 溶血素(2 个单位);
f) 加 2%的绵羊红细胞 0.2 mL;
g) 混匀后放 37 ℃水浴 30 min,判定结果。


结果中产生完全溶血且含补体量最少管为第 8 管,定为 1 个恰定单位,它前 1 管即第 7 管为 1 个完全单位,在正式试验时采用 2 个完全单位的补体量,按下列公式计算出补体的稀释倍数 x。
20:2y(y=1 个完全单位的补体量)=x:0.2 x=20×0.2/2y=2/y。
因为 y=0.08 所以即补体作 1:25 稀释。
9.5.2.2 C.5.2.2 溶血素
a) 首先制备依次递增的溶血素稀释度:
1:10 即 0.1 mL 溶血素+0.9 mL 生理盐水;
1:100 即 0.1 mL(1:10)+0.9 mL 生理盐水;
1:1 000 即 0.5 mL(1:100) +4.5 mL 生理盐水;
1:2 000 即 0.5 mL(1:1 000)+0.5 mL 生理盐水 ;
1:3 000 即 0.5 mL(1:1 000)+1.0 mL 生理盐水;
1:4 000 即 0.5 mL(1:1 000)+1.5 mL 生理盐水;
1:5 000 即 0.5 mL(1:1 000)+2.0 mL 生理盐水;
1:6 000 即 0.5 mL(1:3 000)+0.5 mL 生理盐水;
1:8 000 即 0.5 mL(1:4 000)+0.5 mL 生理盐水;
1:10 000 即 0.5 mL(1:5 000)+0.5 mL 生理盐水;
1:12 000 即 0.5 mL(1:6 000)+0.5 mL 生理盐水;
1:16 000 即 0.5 mL(1:8 000)+0.5 mL 生理盐水。
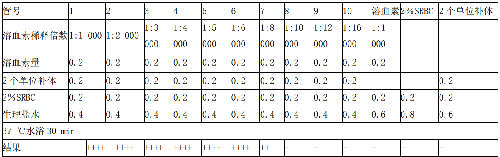
b) 稀释完毕后,取 10 支凝集管,参照表 C.4 顺序加入以下各稀释度溶血素 0.2 mL,2 个单位补体 0.2 mL,2%绵羊红细胞悬液 0.2 mL,并用生理盐水补充至总量为 1 mL。
d) 溶血素对照。1:1 000 溶血素 0.2 mL+2%绵羊红细胞 0.2 mL+生理盐水 0.6 mL。
e) 血球对照。2%绵羊红细胞 0.2 mL+生理盐水 0.8 mL。
f) 补体对照。2 个单位补体 0.2 mL+2%绵羊红细胞 0.2 mL+盐水 0.6 mL。
g) 放 37 ℃水浴 30 min,取出参照表 C.4 判定结果。以完全溶血的溶血素最高稀释度为 1 个溶血素单位,试验时用 2 个单位。
9.5.2.3 C.5.2.3 绵羊红细胞
一般用成年的健康公绵羊红细胞,因母羊红细胞抵抗力不稳定。将采集的血清按1:1放于阿氏液中保存于普通冰箱中,用时以生理盐水离心洗涤3次,再将末压实红细胞配制成2%的红细胞悬液。
9.5.2.4 C.5.2.4 布鲁氏菌抗原
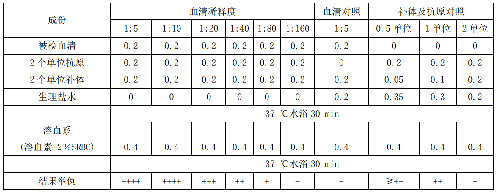
布鲁氏菌补体结合抗原采用可溶性抗原。采用用棋盘式滴定法滴定抗原,步骤如下:
a) 将抗布鲁氏菌阳性或标准血清灭活,并用生理盐水稀释成 1:5、1:10、„„、1:1 280;
b) 在每一行各管加同一稀释度血清 0.2 mL,每一列各管加同一稀释度抗原 0.2 mL;
c) 所有各管加 0.2 mL 2 个单位的补体;
d) 混匀后放 37 ℃水浴 30 min;
e) 取出后向各管加 0.4 mL 的溶血系(2 个单位的溶血素与 2%绵羊红细胞悬液等量混匀);
f) 血清对照(不加抗原); 抗原对照(不加血清); 补体对照(不加抗原或不加血清); 溶血素对照(不加抗原和血清);
g) 放 37 ℃水浴 30 min,参照表 C.5 判定结果。
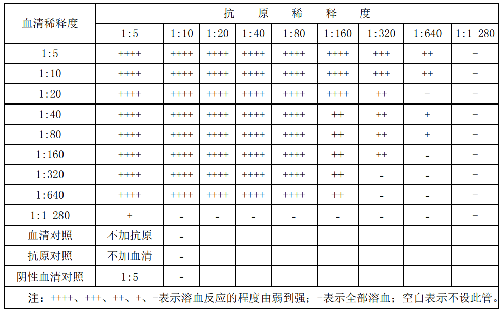
当所有对照管均发生溶血,滴定结果才能成立。在阳性血清最高稀释度中能产生完全不溶血的最高抗原稀释度为 1 个抗原单位,试验时采用 2 个抗原单位。在本例中,1 个抗原单位为 1:80,2 个抗原单位为 1:40。
9.5.2.5 C.5.2.5 待检血清
在试验中待查的人或动物血清,应予以灭活。不同动物血清灭活温度如下:
a) 人、牛、骆驼和猪血清在 56℃~58℃ 30 min 灭活;
9.5.3 C.5.3 补体结合试验
9.5.3.1 C.5.3.1 操作方法
步骤如下:
a) 取 6 支凝集管放于试管架上,将灭活的待检血清从 1:5 开始作对倍稀释直至 1:160 倍。
b) 另取 10 支凝集管放于试管架上,其中 6 支作为反应管,4 支作为对照管。取已稀释好的各稀释倍数血清 0.2 mL 分加于反应管中。
c) 每个反应管加 2 个单位抗原 0.2 mL,2 个单位补体 0.2 mL。
d) 血清对照管加 1:5 血清 0.2 mL+2 个单位补体 0.2 mL+生理盐水 0.2 mL。
——2 个单位抗原 0.2 mL+2 个单位补体 0.05 mL+生理盐水 0.35 mL;
——2 个单位抗原 0.2 mL+2 个单位补体 0.1 mL+生理盐水 0.3 mL;
——2 个单位抗原 0.2 mL+2 个单位补体 0.2 mL+生理盐水 0.2 mL。
f) 混匀,置 37 ℃水浴 30 min。
g) 取出各管加入 0.4 mL 溶血系,再放 37 ℃水浴 30 min,判定结果。
h) 判定结果如下:
+++ 25%溶血,有红细胞沉于管底或为悬液,上清有溶血颜色;
++ 50%溶血,少有红细胞沉于管底或为悬液,上清呈明显溶血颜色;
+ 75%溶血,基本没有红细胞沉于管底或为悬液,上清呈明显溶血颜色,尚不透明;
i) 补体结合试验参照表 C.6 程序操作,对照反应合于要求,被检血清在 1:40 滴度处出现 50%溶
血,其滴度为 1:40。为防止判定的错误,可配制表 C.7 溶血标准管。
j)
9.5.3.2 C.5.3.2 诊断标准
C.5.3.2.1 人及所有动物血清温热补体结合试验以1:10出现抑制溶血为++++、+++、++者为阳性;
C.5.3.2.2 影响因素
a) 进行同一试验时应采用同一种抗原。抗原存放时间长或受污染等易出现抗补体现象。
b) 被检血清应进行灭活,如果灭活不彻底也会影响结果。在试验时尽量用新鲜血清,血清的污染及变性都可能出现抗补体现象。。
c) 补体与溶血素之间有定量关系。当溶血素的含量一定时,增加补体量,溶血增强,但到一定程度不变;补体量一定时,增加溶血素,溶血增强,到一定程度不变。因此在进行补体结合试验时应确定补体当量,或进行补体滴定。
d) 盐类影响血清反应是人们都知道的。如果在补体结合反应中 NaCl、巴比妥缓冲液的克分子浓度增加,补体活性下降。Mg2+缺乏易出现抗补体现象。
9.5.3.3 C.5.3.3 评价
补体结合试验是人兽医广泛应用的诊断布病的手段,尽管操作繁琐,影响因素多,其试验价值及主要优缺点是:
a) 特异性较强。试验结果不仅与布鲁氏菌病临床表现及病期有较好的一致性,而且与牲畜的排菌、带菌均有较高的一致性。
b) 试验所查的布鲁氏菌病抗体类别主要是 IgG 类,结合试管凝集实验结果可以用于判断 IgM、IgG的消长,用作布鲁氏菌病鉴别自然感染和人工免疫的参考试验之一。
c)
d) 试验也可用于查布鲁氏菌抗原。
e) 试验虽然特异性较好,但敏感性较差,不适于大面积检疫采用。
9.6 C.6 抗人免疫球蛋白试验 (Coomb`s)
9.6.1 C.6.1 器材及试剂
除试管凝集试验所需的一般器材及试剂外,还需抗人免疫球蛋白血清及普通离心机。
9.6.2 C.6.2 操作方法
抗人球蛋白反应阶段:选取试管凝集试验的可疑反应管及全部阴性反应管,记录管号,经4 000 r/min离心15 min,用生理盐水反复洗涤、离心3次,然后向各管中加入生理盐水0.5 mL、一定稀释度(一般是1:20倍稀释)的抗人免疫球蛋白血清0.5 mL,混匀,将反应管置37 ℃培养箱孵育20 h~22 h,取出放室温2 h后判定结果。
9.6.3 C.6.3 判定标准
10 附录D(规范性附录)布鲁氏菌的培养及鉴定
10.1 D.1 布鲁氏菌的培养
10.1.1 D.1.1 血培养仪培养布鲁氏菌
10.1.1.1 D.1.1.1 材料与仪器
用血培养仪培养布鲁氏菌的培养瓶种类:标准成人需氧培养瓶(SA),成人需氧中和抗生素培养瓶(FA),成人厌氧中和抗生素培养瓶(FN),小儿需氧瓶(PF)。
10.1.1.2 D.1.1.2 操作程序
步骤如下:
a) 按照培养瓶需要量无菌采集血液或其他体液,注入培养瓶中。
b) 开机启动系统进入初始监视屏幕,待温度达到要求即可开始使用。
c) 培养瓶的装载,按主屏幕上装瓶键,出现装瓶界面。可见每个抽屉底部显示出当前有效单元数量,同时含有效单元的孵育箱指示灯会发出绿光。依次输入培养瓶 ID、登录号、检验号、医院 ID、病人姓名等信息。
d) 打开孵育箱,空载单元会亮绿灯。将培养瓶瓶底插入亮灯单元。单元指示灯闪烁确认培养瓶已被加载。
e) 重复步骤 c)、d)加载培养瓶,关闭孵育抽屉,终止装载过程,启动培养系统。布鲁氏菌一般培养 2 d~7 d。
10.1.1.3 D.1.1.3 阳性标本处理
血培养仪提示培养瓶有疑似菌生长,应取出培养瓶至符合相应生物安全条件的实验室进行后续操作:
a) 取出显示有细菌生长的培养瓶,用 75%的酒精消毒瓶口,颠倒混匀培养瓶数次。
d) 将无菌注射器针头插入瓶口,抽取培养液 0.5 mL 接种于血平板、巧克力或布氏琼脂平板上,37 ℃培养 24 h~48 h,取培养物进行布鲁氏菌鉴定实验。
e) 作为快速诊断参考,抽取少量培养液涂布于玻片上作革兰染色镜检,发现革兰阴性沙粒状微小细菌,结合相关实验,可以报告检出疑似布鲁氏菌结果。
注:血培养仪有型号的不同,应按照操作说明进行操作。
10.1.2 D.1.2 双相血培养瓶培养布鲁氏菌
10.1.2.1 D.1.2.1 材料与仪器
D.1.2.1.1 材料:布鲁氏菌的培养采用需氧双相培养瓶。
D.1.2.1.2 仪器:细菌培养箱,设定37 ℃,培养物疑似牛种布鲁氏菌等需要CO2时,纯培养应采用CO2培养箱。CO2培养箱亦可以用于其他种布鲁氏菌培养。
10.1.2.2 D.1.2.2 操作程序
操作程序如下:
b) 将接种的培养瓶放入培养箱,布鲁氏菌一般培养 1 周~2 周,最长 4 周。
c) 阳性标本处理。取出在固相琼脂上显示有细菌生长的培养瓶,用 75%的酒精或酒精灯消毒瓶口,打开培养瓶盖。接种环插入瓶口,挑取单个菌落接种于血平板、巧克力、布氏琼脂平板上,37 ℃培养 18 h~24 h,取培养物进行布鲁氏菌鉴定实验。
10.1.3 D.1.3 病理材料培养布鲁氏菌
从病人的血液、骨髓和其他病理材料直接接种或研磨后接种血平板、巧克力、布氏琼脂平板上或中试管斜面,37 ℃培养1周~4周,取培养物进行布鲁氏菌鉴定实验。
从疑似病人无菌采血1 mL注入培养容器,使被检血液均匀涂布在培养基上,置37 ℃培养箱中培养,3 d后观察结果,如果没有生长,再次使血液涂在培养基上,继续培养,隔日观察1次。如果有疑似布鲁氏菌生长,则用接种环取出,纯分离和进一步鉴定。如果培养物疑似牛种布鲁氏菌等需要CO2时,应采用5%~10% CO2培养箱培养。
10.2 D.2 布鲁氏菌的鉴定
10.2.1 D.2.1 布鲁氏菌的血清凝集
10.2.1.1 D.2.1.1 玻片凝集试验
在清洁玻片上各滴一滴A、M血清,在另一端再滴一滴生理盐水,然后用接种环勾取少许待检布鲁氏菌48 h培养物,在生理盐水中研磨制成菌悬液,用接种环勾取菌悬液分别加入A和M血清中混匀,在2 min内出现凝集颗粒为阳性;否则为阴性。
10.2.1.2 D.2.1.2血清凝集意义
待检菌株可能出现与A凝集而与M不凝集,与M凝集而与A不凝集,与M和A均凝集或均不凝集四种情况,各情况意义如下:
a) 待检菌在 A 血清中凝集,而在 M 血清中不凝集或 A 血清凝集滴度高于 M,可能是羊种 2 型布鲁氏菌、牛种 1~3 型或牛种 6 型布鲁氏菌、猪种 1~3 型布鲁氏菌及沙林鼠种布鲁氏菌。
b) 待检菌在 M 血清中凝集,而在 A 血清中不凝集或 M 血清凝集滴度高于 A,可能是羊种 1 型或牛种 4、5、9 型布鲁氏菌。
c) 待检菌在 A 和 M 血清中均凝集或滴度相近似,可能是种羊 3 型、牛种 7 型或猪种 4 型布鲁氏菌。
d) 待检菌在 A 和 M 血清中均不凝集或滴度很低,可能是绵羊附睾种、犬种或其他粗糙型布鲁氏菌及无凝集原性布鲁氏菌。
e) 疑似粗糙型(R)菌,或者菌株疑似发生粗糙型变异,需要进行 R 血清凝集试验。
10.2.2 D.2.2 布鲁氏菌噬菌体裂解试验
10.2.2.1 D.2.2.1 实验方法
将增殖菌比浊成 10 亿菌体/mL 或 OD 值为 1.5 的菌液浓度,取 0.1 mL 此菌液加到溶化并在 52 ℃水浴保温的布氏半固体培养基中,缓缓混匀,然后倾注到底层为布氏琼脂培养基上。菌液半固体凝固后,用加样器分别吸取被测 1RTD 浓度或特定浓度噬菌体 8 μL,分别滴加在菌液半固体琼脂表面的不同位置上,待噬菌体液干后,置 37 ℃温箱中培养,24 h~48 h 观察试验结果。
10.2.2.2 D.2.2.2 布鲁氏菌噬菌体裂解试验结果判定
在滴加噬菌体处出现透明的噬菌斑即为裂解,否则为不裂解。结果判定如下:
a) Bk 噬菌体在 RTD 下只裂解所有光滑型布鲁氏菌,不裂解粗糙型布鲁氏菌及其他种细菌。
b) Tb 噬菌体在 RTD 下只裂解光滑型牛种布鲁氏菌,不裂解其他种布鲁氏菌。在当浓度增大到 104×RTD 时,还会裂解光滑型猪种布鲁氏菌,不裂解其他种布鲁氏菌及其他种细菌。
c) Wb 噬菌体在 RTD 下只裂解光滑型牛种、猪种和沙林鼠种布鲁氏菌,不裂解其他种布鲁氏菌及其他种细菌。
10.2.3 D.2.3 布鲁氏菌硫化氢产生量测定
10.2.3.1 D.2.3.1 实验材料
无菌、沾有 10%醋酸铅 8 cm×0.8 cm 普通滤纸条、pH 6.8 的琼脂斜面试管培养基和 48 h 培养的待检布鲁氏菌菌株。
10.2.3.2 D.2.3.2 实验方法
将待检菌 48 h 培养物用灭菌生理盐水制成 10 亿菌体/mL 或 OD 值为 1.5 的菌悬液,用加样器吸取100 μL 菌液接种在 pH 6.8 的琼脂斜面上,将醋酸铅滤纸条夹于斜面与管壁之间,使滤纸条和斜面保持平行,以不接触斜面为宜。滤纸条留在管外约 1 cm,置 37 ℃温箱培养,经 2 d、4 d、6 d 各观察一次结果,以 cm 计算滤纸条变黑长度。每观察一次更换一个滤纸条,3 次变黑长度总和为最后结果,不变黑为阴性。
10.2.3.3 D.2.3.3 实验意义
猪种 1 型布鲁氏菌产生硫化氢量最多,持续时间可达 10 d,滤纸条变黑部分可达 19 mm。
牛种布鲁氏菌 1~4 型和 9 型布鲁氏菌,沙林鼠种布鲁氏菌均能产生中等量的硫化氢,滤纸条变黑部分 5 mm~8 mm。
牛种布鲁氏菌 6 和 7 型的部分菌株也能产生少量的硫化氢。
其余种型布鲁氏菌不产生硫化氢。有时猪种3 型、羊种 1 布鲁氏菌亦可产生微量硫化氢,使滤纸条下端呈现黑褐色一个小边。该实验需要有参考菌株进行对照。
10.2.4 D.2.4 生化鉴定仪鉴定布鲁氏菌属及布鲁氏菌种
D.2.4.1 培养 18 h~24 h 分离纯化布鲁氏菌,配制布鲁氏菌 0.85% NaCl 溶液菌悬液,并用比浊仪测定菌液浓度为 0.5 McF~0.63 McF。
D.2.4.2 将革兰阴性细菌鉴定卡片在室温复温,菌液加入鉴定卡中,按顺序放在载卡架上,输样管插入到菌液管中。
D.2.4.3 鉴定卡片装载入仪器孵育仓,输入相应编号。仪器每隔一定时间自动阅读孵育仓内所有卡片,电脑分析所有数据并给予结果,发放检测报告。
D.2.4.4 布鲁氏菌的鉴定时间一般为 6 h~10 h。
a) 布鲁氏菌属为 ProA、TyrA、URE、GlyA、1LATK、ELLM 阳性;
b) 牛种布鲁氏菌为 1LATK 、ProA、TyrA、URE、GlyA 阳性;
c) 羊种布鲁氏菌为 ProA、TyrA、URE、GlyA 阳性;
10.2.5 D.2.5 布鲁氏菌核酸检测
10.2.5.1 D.2.5.1 BCSP31聚合酶链式反应(BCSP31-PCR)
10.2.5.1.1 D.2.5.1.1 器材及试剂
器材:无菌0.2 mL PCR管、10 μL、20 μL、200 μL的移液器及移液器吸头。
试剂:Taq DNA聚合酶、10×Buffer(不含MgCl2)、25 mM MgCl2、dNTPs、三蒸水、引物、琼脂糖凝胶、待检菌株核酸。
10.2.5.1.2 D.2.5.1.2 引物
Primer B4 5’-TGG CTC GGT TGC CAA TAT CAA-3’(789-809)
Primer B5 5’-CGC GCT TGC CTT TCA GGT CTG-3’(1012-992)
10.2.5.1.3 D.2.5.1.3 实验方法
按照表D.1反应体系加入PCR管,参照表D.2设定扩增参数.
表 D.1 BCSP31-PCR 反应体系

10.2.5.1.4 D.2.5.1.4 设置参数
表D.2 BCSP31-PCR扩增参数

10.2.5.1.5 D.2.5.1.5 结果判定
PCR产物在1.5%琼脂糖上电泳,紫外透射仪或凝胶成像系统中观察到扩增目的片段长度为224 bp判为实验阳性。
10.2.5.2 D.2.5.2 AMOS聚合酶链式反应(AMOS-PCR)
10.2.5.2.1 D.2.5.2.1 器材及试剂
器材:无菌0.2 mL PCR管、10 μL、20 μL、200 μL的移液器及移液器吸头
试剂:Taq DNA聚合酶、10×Buffer(含Mg2+)、dNTPs、三蒸水、引物、琼脂糖凝胶、待检菌株核酸DNA。
10.2.5.2.2 D.2.5.2.2 引物
IS711: tgc cga tca ctt aag ggc ctt cat
A: gac gaa cgg aat ttt tcc aat ccc
M: aaa tcg cgt cct tgc tgg tct ga
O: cgg gtt ctg gca cea tcg tcg
S: gcg cgg ttt tct gaa ggt tca gg
10.2.5.2.3 D.2.5.2.3 实验方法
AMOS-PCR反应体系:
25 µL体系:10×Buffer(含Mg2+)2.5μL ;dNTP(2.5 mmol/L)2μL;TaqDNA聚合酶(1 U/μL )1μL;
primerlS711(10 pmol)1μL ; primerA、M、O、S(10 pmol )各0.4μL ;待检菌株核酸DNA lμL,补足三蒸水至15.9 μL。
10.2.5.2.4 D.2.5.2.4 扩增
扩增参数:94 ℃ 4 min;95 ℃ 1 min、60 ℃ 1 min、72 ℃ l min;30个循环;未循环72 ℃ 5 min。
10.2.5.2.5 D.2.5.2.5 结果判定
扩增PCR产物经1.5%琼脂糖凝胶电泳检测,以DL2000 DNA Ladder为分子量标准,均在相应的位置出现预期大小的DNA条带。AMOS—PCR根据条带情况可鉴别布鲁氏菌牛种1、2、4型(498 bp)、羊种布鲁氏菌(731 bp)、猪种1型(285 bp)、绵羊附睾种(96l bp)。AMOS-PCR检测4个种的一些生物型布鲁氏菌是国内主要引起人感染的流行菌种(型)。
10.2.6 D.2.6 布鲁氏菌基因组DNA提取操作方法
10.2.6.1 D.2.6.1 DNA试剂盒提取布鲁氏菌基因组DNA
10.2.6.1.1 D.2.6.1.1 器材及试剂
细菌基因组DNA提取试剂盒(本操作以1种商品试剂为例)、TE缓冲液、1.5 mL Eppendorf无菌管、200μL~1 000μL移液器、10 μL接种环、光密度仪、水浴锅。
10.2.6.1.2 D.2.6.1.2 实验方法
实验操作方法如下:
a) 在实验室生物安全柜中,将 1.5 mL Eppendorf 管编号,并向编号的 Eppendorf 管中加入高压过的生理盐水 500 μL,用接种环挑取适量分离培养好的布鲁氏菌至 Eppendorf 管制成 OD=3.0菌悬液。
b) 制成的菌悬液加盖密闭,可移至生物安全柜外,在实验室内,置试管架上在水浴锅 80 ℃,30min,灭活菌液。
c) 将灭活的菌悬液 12 000 r/min 离心 30 min,弃去上清。此操作在 BSL-2 实验室内进行。
d) 向菌体沉淀中加入 200 μL 缓冲液 GA,使用旋涡混合器,振荡至菌体彻底悬浮。
f) 加入 220 μL 缓冲液 GB,旋涡混合器振荡 15 s,70 ℃放置 10 min,溶液应变清亮,瞬时离心以去除管盖内壁的水珠。加入缓冲液 GB 时可能会产生白色沉淀,一般 70 ℃放置时会消失,不会影响后续实验.如溶液未变清亮,说明细胞裂解不彻底,可能导致提取 DNA 量少和提取出的DNA 不纯。
g) 加入 220 μL 无水乙醇,振荡混匀 15 s,此时可能会出现絮状沉淀,瞬时离心以去除管盖内壁的水珠。
h) 将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12 000 r/min离心 30 s,弃掉废液,吸附柱 CB3 放入收集管中。
i) 向吸附柱 CB3 中加入 500 μL 去蛋白液 GD(使用前请先检查是否已加入无水乙醇),12 000r/min 离心 30 s,弃掉废液,吸附柱放入收集管中。
j) 向吸附柱CB3中加入700 μL漂洗液PW(使用前请先检查是否已加入无水乙醇),12 000 r/min离心 30 s,弃掉废液,吸附柱放入收集管中。
k) 向吸附柱 CB3 中加入 500 μL 漂洗液 PW,12 000 r/min 离心 30 s,弃掉废液,将吸附柱 CB3放入收集管中。
l) 将吸附柱 CB3 放入收集管中,12 000 r/min 离心 2 min,弃掉废液,将吸附柱 CB3 开盖置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。这一步目的是将吸附柱中残余的漂洗液去除,漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR 等)实验。
m) 将吸附柱 CB3 转入一个干净的离心管中,向吸附柱的中间部位悬空滴加 50 μL~200 μL 洗脱缓冲液 TE,室温放置 2 min~5 min,12 000 r/min 离心 2 min,将提取的 DNA 溶液收集到离心管中。
n) 为增加基因组 DNA 的获得率,可将离心得到的溶液再加入吸附柱 CB3 中,室温放置 2 min,12 000 r/min 离心 2 min。洗脱缓冲液体积不应少于 50 μL,体积过小影响回收效率。洗脱液的 pH 值对于洗脱效率有很大影响。
DNA产物应密闭保存在≤-20 ℃冰箱,以防DNA降解。
注:所有操作严格按照试剂盒介绍进行,如试剂或介绍有变动,则以介绍为准。
10.2.6.2 D.2.6.2 煮沸裂解法提取布鲁氏菌基因组DNA步骤如下:
a) 菌液准备。用生理盐水将布鲁氏菌制备成 OD=3.0 菌悬液,取 l mL 放入 1.5 mL 的 EP 管,13 000r/min 高速离心 1 min,弃掉上清液。
b) 菌体裂解。用 1 mL 的 TE 缓冲液将菌体悬浮混匀,置沸水中 10 min。
c) 菌体 DNA 制备。13 000 r/min 高速离心 10 min,取上清液即为菌体 DNA。
d) 无菌试验。吸取 1/10 体积的 DNA 溶液接种适宜培养基,放入 37 ℃培养箱中培养。72 h 后观察确认无细菌生长后,为实验用 DNA。
10.3 D.3 布鲁氏菌实验生物安全要求
D.3.1 根据卫生部 2006 年发布的《人间传染的病原微生物名录》,涉及抗原制备的大量活菌操作,或易产生气溶胶的病原菌离心、冻干以及活菌感染的动物等实验需要在生物安全三级实验室操作。布鲁氏菌样本的病原菌分离纯化、药物敏感性实验、生化鉴定、免疫学实验、PCR 核酸提取、涂片、显微镜观察等初步检测在生物安全二级实验室操作。不含布鲁氏菌致病性活菌材料的分子生物学、血清免疫学等实验在生物安全一级实验室操作。
D.3.2 运输包装分类:按卫生部2005年第45号令《可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定》和国际民航组织文件Doc 9284《危险品航空安全运输技术细则》的分类包装要求,布鲁氏菌病原菌和标本应按A类UN 2814的要求包装和空运;通过其他交通工具运输的可参照标准包装。
11 附录E(资料性附录)鉴别诊断
11.1 E.1 伤寒、副伤寒
伤寒、副伤寒患者以持续高热、表情淡漠、相对脉缓、皮肤有玫瑰疹、肝脾肿大为主要表现,而无肌肉、关节疼痛、多汗等布鲁氏菌病表现。实验室检查血清肥达反应阳性,伤寒杆菌培养阳性,布鲁氏菌病特异性检查为阴性或弱阳性。
11.2 E.2 风湿热
布鲁氏菌病与风湿热均可出现发热及游走性关节痛,但风湿热可见风湿性结节及红斑,多合并心脏损害,而肝脾肿大、睾丸炎及神经系统损害极为少见。实验室检查抗链球菌溶血素“O”为阳性,布鲁氏菌病特异性检查为阴性。
11.3 E.3 风湿性关节炎
慢性布鲁氏菌病和风湿性关节炎均是关节疼痛严重,反复发作、阴天加剧。风湿性关节炎多有风湿热的病史,病变多见于大关节,关节腔积液少见,一般不发生关节畸形,常合并心脏损害,血清抗链球菌溶血素“O”滴度增高,布鲁氏菌病特异性实验室检查阴性有助于鉴别。