版本:国家药品监督管理局2002年公布的第四批化学药品说明书马来酸噻吗洛尔片说明书由国家药品监督管理局于2002年04月16日药监注函[2002]106号《关于公布第四批化学药品说明书目录的通知》发布。国家药品监督管理局公布的说明书是规范修订后的建议参考样稿,企业如有疑异,可提出修改意见。〔适应症〕应与原批准的内容一致;〔不良反应〕、〔药物相互作用〕等项内容,企业提供的说明书不能比样稿所列的少。对于说明书样稿中的空项或未列全的项目,应要求企业根据实际情况填写,如商品名、规格等。
马来酸噻吗洛尔片说明书
【药品名称】
通用名:马来酸噻吗洛尔片
曾用名:
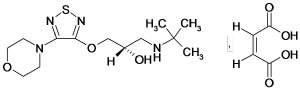
商品名:
英文名:Timolol Maleate Tablets
汉语拼音: Malaisuan Saimaluo’er Pian
本品主要成分及其化学名称为:(-)-1-(叔丁氨基)-3-[(4-吗啉基-1,2,5-噻二唑-3-基)氧]-2-丙醇顺丁烯二酸盐。
结构式:
分子式:C13H24N4O3S·C4H4O4
分子量:432.49
【性状】
【药理毒理】
1. 药理
本品为β肾上腺能受体拮抗剂,无抑制心肌作用和内源拟交感活性。临床药理研究证实β受体拮抗剂可改变静息心率及对体位改变时心率的反应,抑制异丙肾上腺素引起的心动过速,改变对瓦尔萨瓦尔试验的反应,减少活动时心率和血压的变化。并降低β受体激动剂所致的正性变力、正性变时、支气管及血管扩张作用。此降低作用的程度与交感紧张性及其在受体部位的浓度成正比。还可降低健康人及心脏病病人的心排血量。对于有严重心肌损害的病人,β阻滞剂可降低交感神经系统维持必要心功能所产生的兴奋作用。其作用于支气管及细支气管,可引起气道阻力增加。此作用对于哮喘及其他有支气管痉挛情况的病人具有潜在危险性。
本药对雌性小鼠的半数致死量LD50是1190mg/kg,雌性大鼠是900mg/kg。
通过对大鼠2年的研究显示,予马来酸噻吗洛尔300mg/kg/日(相当体重50kg人群最大建议剂量250倍)的雄鼠肾上腺嗜咯细胞瘤的发生率明显升高。如予建议最大剂量20或80倍的剂量不会发生此反应。
对小鼠的终生研究发现,雌鼠500mg/kg/日(相当于体重为50人群的建议最大剂量的400倍) 的肺部良恶性肿瘤、良性子宫息肉及乳腺癌的发生率都有统计学上的明显增高。但如予5或50 mg/kg/日则不会发生。在死后肺部及子宫的尸检中再次发现,予500mg/kg/日的雌鼠肺部肿瘤的发生率在统计学上明显升高。且予500mg/kg/日的雌鼠在乳腺癌发生率升高的同时伴有血清泌乳刺激素的增高。而对于5 或50mg/kg/日的剂量不会伴有增高。但目前尚未证实人类血清泌乳刺激素与乳腺肿瘤的关系。而且成年女性在接受最大建议剂量60mg后,血清泌乳刺激素无临床意义上的改变。
通过评价小鼠的微核检测、细胞遗传学检测(剂量至800mg/kg)及肿瘤细胞变异检测(100μg/mL)无致突变潜能。
对雄性及雌性大鼠的生殖研究中发现,当予以相当50kg人最大建议剂量的125倍时尚无毒副作用。
在对小鼠、大鼠及兔的妊娠研究显示予以50mg/kg/日 (相当50kg人最大建议剂量的40倍)时无胎儿畸形。虽然在此剂量可发现胎儿骨化,但对出生后生长发育无影响。当予小鼠1000mg/kg/日(相当于830倍50kg人最大建议剂量)时可引起妊娠毒性及增加胎儿再吸收的数目。
【药代动力学】
口服吸收约为90%。服后1至2小时作用达峰值。半衰期T1/2为4小时,部分在肝脏代谢,药物和代谢产物均由肾脏排除。不广泛结合血浆蛋白,在血液透析时不易清除,大约60%被超滤过。口服给药的血浆浓度大约为静脉给药的一半,表明50%首次通过代谢。本品交感活性个体差异较大,治疗效应与血药浓度并无明显相关。
【适应症】
1. 原发性高血压病
3. 预防偏头痛
【用法用量】
1.高血压
开始剂量一次2.5mg至5mg,一日2 至3 次,根据心率及血压变化可增减量。维持量通常为20mg 至40mg。最大量可为60mg一日。增加药物的间期应该至少为7天。可与噻嗪类或其他抗高血压药物合用,在此伴随治疗初期应密切观察。
2. 心肌梗死
2.5mg一次,一日2次开始,可渐增至每日总量20mg。
3.偏头痛
10mg一次,一日2次。根据临床反应及耐受性可渐增至一日总量30mg,或减至10mg一日。6至8周无效则应停用。
【不良反应】
在挪威多中心试验中,冠心病病人对于噻吗洛尔及安慰剂的不良反应发生率和停药发生率的比较如下:
不 良 反 应 | 停 药 | |||
% (n=945) | % (n=939) | % (n=945) | % (n=939) | |
5 | 1 | <1 | <1 | |
心动过缓 | 5 | <1 | 4 | <1 |
非致命性心功能不全 | 8 | 7 | 3 | 2 |
3 | 2 | 3 | 1 | |
非致命性肺水肿 | 2 | <1 | <1 | <1 |
跛行 | 3 | 3 | 1 | <1 |
2至3度房室传导阻滞 | <1 | <1 | <1 | <1 |
<1 | <1 | <1 | <1 | |
雷诺氏征 | 8 | <1 | <1 | 0 |
8 | 6 | 1 | <1 | |
6 | 4 | 1 | 0 | |
支气管阻塞 | 2 | <1 | 1 | <1 |
临床试验室检查:可有血尿素氮、血钾、血尿酸、血三酰甘油轻度升高,血色素、血细胞比容、高密度脂蛋白轻度降低。但无明显临床意义。尚无肝功能检查指标升高的报道。
【禁忌】
2. 严重慢性阻塞性肺病
3. 窦性心动过缓
4. 二至三度房室传导阻滞
5. 难治性心功能不全
6. 心源性休克
7. 对本品过敏者
【注意事项】
1.交感神经兴奋对于加强心功能降低病人的循环是必要的,而β阻滞剂可抑制此作用而引起心功能恶化。
(1)对于经常予洋地黄及利尿剂治疗且心功能易代偿的心功能不全病人,在必要的时候可以使用本药。但应注意洋地黄药物及本品均能延迟房室传导。如心功能不全持续则应停用本品。
(2)在某些情况可引起心功能不全,故服用本品的病人在初发心功能不全症状时,应先给洋地黄和利尿剂,且被密切观察。如心功能不全持续,应予足够的洋地黄及利尿剂等治疗,并停用本品。
2.突然停药可引起缺血性心脏病的恶化,如心绞痛恶化及发生心肌梗死。故停药需要1至2周的逐渐减量过程,且需密切观测病人。如心绞痛加重或急性冠状动脉供血不足加重,应迅速重新调整剂量,且应给予不稳定心绞痛的相应治疗措施。病人应被警告在无医生的建议下不能擅自停药。
3.轻中度慢性阻塞性肺病(如慢性支气管炎,肺气肿),支气管痉挛或有支气管痉挛病史的病人通常不接受本品治疗。但如必要,则应在密切检测下慎用。
4.是否有必要在较大规模的外科手术前停用β阻滞剂是有争论性的。β阻滞剂可削弱心脏对β肾上腺能介导的反射性刺激所发生反应的能力。一些接受β阻滞剂的病人在麻醉中出现严重低血压。也有心脏复苏及维持心率困难的报道。由于上述原因一些权威人士建议在某些手术前应逐步停用β阻滞剂。
5.自发性低血糖或接受胰岛素或口服降糖药治疗的糖尿病病人(尤其是不稳定糖尿病 )应慎用本品。因为β阻滞剂可掩盖急性低血糖的症状及体征。
6. 本品可掩盖甲状腺功能亢进的一些临床体征(如心动过速)。怀疑为甲状腺毒症的病人应避免突然停药。
7. 因本品在肝脏代谢及由肾脏排除体外,故有肝脏及肾功能不全的病人应减量。尤其对有明显肾功能衰竭的病人,用药剂量应更应谨慎。
8. 由于β阻滞剂可影响血压及心率,故有心脑血管供血不足的病人应慎用。如发现有脑血管血流量降低的症状或体征出现,应考虑停用本品。
【孕妇及哺乳期妇女用药】
对孕妇用药尚无充分研究。
本品已在母乳中发现。由于在哺乳中本品严重不良反应的潜在性存在, 决定是否中止哺乳或中止用药需要考虑本品对母亲病情的重要性。
【儿童用药】
【老年患者用药】
尚无资料记载。
【药物相互作用】
1. 与儿茶酚胺耗竭剂合用,如利血平,可有叠加作用,发生低血压或心动过缓,眩晕等。
2. 与非类固醇类抗炎药合用可减弱降压效果。
3. 钙离子拮抗剂:心功能正常时可合用。但如心功能降低时应避免合用。在合用病例中,低血压,房室传导阻滞及左心功能不全曾被报道。低血压易发生于二氢吡啶类,左心室功能衰竭及房室传导阻滞易发生于维拉帕米和地尔硫卓。对接受本品治疗的病人应慎用静脉钙离子拮抗剂。
4. 洋地黄,地尔硫卓或维拉帕米与本品合用可增加延长房室传导阻滞作用。
6. 可乐定:本品可加重可乐定停药后的血压反弹。如二者合用,本品应在可乐定逐渐停药前几天停药。如以本品替代可乐定,应在停可乐定数天后方能应用本品。
7. 对于有遗传性过敏史的病人,当服用本品时可能减弱抗过敏药的作用。
【药物过量】
本药药物过量的最常见体征和症状是心动过缓,低血压,急性心功能不全。应停用本药并密切观察。其他治疗措施如下:
1.洗胃
2.治疗心动过缓:静脉予阿托品0.25mg至2mg。如果心动过缓持续存在,可慎用静脉盐酸异丙肾上腺素。必要时可考虑安装临时起搏器。
3.治疗低血压:可予升压药,如多巴胺,多巴酚丁胺,去甲肾上腺素等 。有报道盐酸胰高血糖素也可起作用。
4.治疗急性心功能不全:传统疗法应立即予洋地黄,利尿剂,吸氧治疗等。也可予氨茶碱。有报道盐酸胰高血糖素也可起作用。
5.治疗二至三度房室传导阻滞:可予盐酸异丙肾上腺素或安装临时起搏器。
【规格】
【贮藏】
【包装】
【有效期】
【批准文号】
【生产企业】
企业名称:
地 址:
邮政编码:
电话号码:
传真号码:
网 址: