3 基本信息
ICS 11.020
CCS C 50
中华人民共和国卫生行业标准WS/T 805—2022《临床微生物检验基本技术标准》(Basic technical standard for clinical microbiology laboratory)由中华人民共和国国家卫生健康委员会2022年11月2日《关于发布〈临床化学检验基本技术标准〉等4项推荐性卫生行业标准的通告》(国卫通〔2022〕12号)发布,自2023年5月1日起施行。
4 发布通知
关于发布《临床化学检验基本技术标准》等4项推荐性卫生行业标准的通告
国卫通〔2022〕12号
现发布《临床化学检验基本技术标准》等4项推荐性卫生行业标准,编号和名称如下:
WS/T 804—2022 临床化学检验基本技术标准
WS/T 807—2022 临床微生物培养、鉴定和药敏检测系统的性能验证
上述标准自2023年5月1日起施行。
特此通告。
国家卫生健康委
2022年11月2日
5 前言
本标准由国家卫生健康标准委员会临床检验标准专业委员会负责技术审查和技术咨询,由国家卫生健康委医疗管理服务指导中心负责协调性和格式审查,由国家卫生健康委医政司负责业务管理、法规司负责统筹管理。
本标准起草单位:华中科技大学同济医学院附属同济医院、中国人民解放军总医院、北京医院/国家卫生健康委临床检验中心、中国医学科学院北京协和医院、北京大学人民医院、安徽省立医院。
本标准主要起草人:沈定霞、孙自镛、胡继红、徐英春、胡云建、王辉、马筱玲、简翠。
6 标准正文
6.1 1 范围
6.2 2 规范性引用文件
下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本标准;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。
GB 19489 实验室生物安全通用要求
WS/T 442 临床实验室生物安全指南
6.3 3 术语和定义
下列术语和定义适用于本标准。
3.1
消毒 disinfection
3.2
灭菌 sterilization
杀灭物体上所有微生物(包括细菌芽胞在内的全部病原微生物和非病原微生物)的方法。
3.3
无菌 asepsis
指不存在活菌。
3.4
无菌操作 aseptic operation
3.5
接种 inoculation
将目标微生物转移至适于生长繁殖的人工培养基或活的生物体内的方法。
3.6
荧光淬灭 fluorescence quenching
指由于荧光分子与其他分子发生作用而出现的光度降低、发光时间缩短乃至停止发光的现象。
3.7
一套血培养 a set of blood culture
从同一个穿刺点采集的血液,通常分别注入一个需氧血培养瓶和一个厌氧血培养瓶进行血培养。
3.8
微生物培养 microbial culture
利用人工培养基和适宜的培养条件(如温度、气体环境等),使微生物生长繁殖的技术。
3.9
细菌鉴定 identification of bacteria
以细菌系统分类学为原则,通过一系列的方法,将未知细菌归到一定种属的过程。
6.4 4 无菌操作及消毒灭菌技术要求
6.4.1 4.1 无菌操作技术要求
对各类标本进行采集、接种等过程及对已生长的微生物进行血清凝集、鉴定和药敏试验等操作时需要进行无菌操作。无菌操作技术要求包括:
d) 接种标本或转种菌株应将接种环(针)加热灭菌,或使用一次性无菌接种环(针);
e) 打开容器挑取标本或培养物后,应尽快盖回盖子,防止他们被污染或造成交叉污染;
f) 用加样器和吸头从试管中吸取体液标本或菌液时,应注意加样器勿接触管壁。
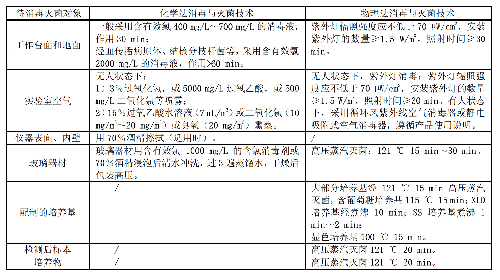
6.4.2 4.2 消毒灭菌技术要求
6.5 5 标本处理及制片技术要求
6.5.1 5.1 标本处理的技术要求
微生物实验室根据标本类型、性状以及目标微生物种类进行标本处理的技术要求见表2。

6.5.2 5.2 制片的技术要求
6.5.2.1 5.2.1 制片的种类与技术要求
制片宜在生物安全柜内进行并尽可能使其自然干燥,不建议加热干燥,若采用烤片机,温度宜控制在60 ℃以下。用于检查分枝杆菌的涂片必须在Ⅱ级生物安全柜内进行。制片的种类与技术要求见表3。
表3 制片的种类与技术要求

6.5.2.2 5.2.2 固定
为了使标本贴紧载玻片,需进行固定,防止染色过程中脱落。可采用加热固定或使用甲醇固定。加热固定时,载玻片要迅速通过酒精灯的外焰,来回3次;利用电热灭菌器固定时,不要将载玻片紧贴电热灭菌器,时间不宜超过10 s;采用甲醇固定时,将无水甲醇覆盖在已加有标本的载玻片上,待其挥发干后即可使用。
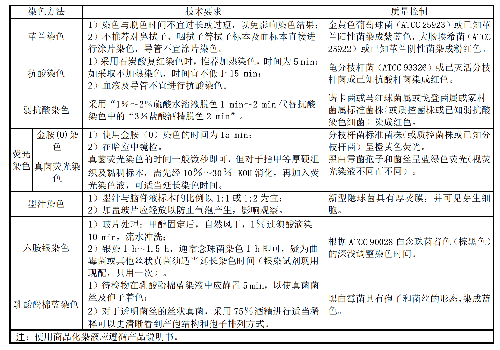
6.6 6 染色技术要求
6.7 7 显微镜检查技术要求
6.7.1 7.1 普通光学显微镜检查的技术要求
6.7.1.1 7.1.1 革兰染色标本的镜检要求
a) 在油镜下观察菌体形态、排列、染色性,以及细菌是否在白细胞内或白细胞周围;
b) 将血液及脑脊液培养阳性标本革兰染色镜检结果作为危急值报告;对于痰及气管抽吸物标本宜根据低倍镜下鳞状上皮细胞数量及白细胞数量判断是否合格;未离心尿液中,若每个油镜视野看到1个细菌,相当于尿液细菌计数105/mL;生殖道标本若见到革兰阴性双球菌,宜报告其是否位于中性粒细胞内;
c) 若在低倍镜下发现真菌菌丝或孢子,应转换至高倍镜或油镜确认。
6.7.1.2 7.1.2 抗酸及弱抗酸染色标本的镜检要求
a) 观察抗酸染色标本时,要将玻片按一定方向及顺序移动,做到不漏检、不重复。连续观察300个油镜视野未发现抗酸杆菌,方可报告抗酸染色阴性;
b)观察弱抗酸染色标本时,应注意尽可能全范围、多视野进行观察,并注意菌体的形态和排列。
6.7.1.3 7.1.3 墨汁染色标本的镜检要求
在低倍镜下寻找有荚膜的酵母细胞,找到后,转换至高倍镜下确认。具有宽厚荚膜且伴有或不伴有出芽者为隐球菌,脑脊液中发现隐球菌需按危急值报告。治疗后菌体减少,荚膜变薄,要注意识别。
6.7.1.4 7.1.4 乳酸酚棉蓝染色标本的镜检要求
观察真菌菌丝、孢子的形态,以及菌丝与孢子的关系。注意培养基种类和丝状真菌的培养时间会影响孢子的形成。
6.7.1.5 7.1.5 不染色标本的镜检要求
a)经阴道采样制作的湿片:注意观察白细胞、黏附细菌的鳞状上皮细胞、酵母菌和阴道滴虫等;
b)KOH湿片:注意观察真菌结构,如酵母细胞、菌丝和横隔等。
6.7.2 7.2 荧光显微镜检查的技术要求
荧光显微镜主要用于观察没有自发荧光、经荧光染色后能发出荧光的病原体。荧光染色后的标本要尽快观察,避免荧光淬灭对观察结果的影响;用油镜观察标本时,采用无荧光的特殊镜油;可在高倍镜(物镜40倍,目镜10倍)观察涂片,至少连续观察50个视野未发现抗酸杆菌,方可报告荧光染色抗酸杆菌阴性;荧光染色观察真菌时,应注意具有不同荧光颜色和荧光强度的真菌孢子和菌丝。
6.7.3 7.3 暗视野显微镜检查的技术要求
在暗室内进行暗视野显微镜的观察。如无暗室,应尽可能使用遮光装置,以阻止目镜周围的光线射入。若视场中样品与背景明暗反差不强,可调节聚光器的位置以提高照明光源的照明强度。在暗视野显微镜下观察到运动活泼、呈穿梭状或流星状运动的细菌,应用O1群及O139群霍乱弧菌凝集血清分别做制动试验。暗视野显微镜下观察梅毒螺旋体时,应注意寻找细长、两端尖锐、弹簧或螺旋状、折光强的菌体,并注意其是否沿纵轴旋转并可前后运动。
6.8 8 接种技术要求
6.8.1 8.1 微生物不同接种方式的技术要求
微生物不同接种方式的技术要求见表5。
表5 微生物不同接种方式的技术要求

表5 微生物不同接种方式的技术要求(续)

6.8.2 8.2 微生物接种通用的技术要求
a)临床微生物标本接种应在二级生物安全柜中进行(参见GB 19489和WS/T 442)。标本接种过程要注意无菌操作,避免培养基受到环境微生物污染;
b)实验室收到标本后应尽快接种。如果不能及时接种,应根据所培养的目标细菌选择合适的标本存储条件,或在收集标本时,选用适当的转运培养基。避免延迟接种导致的细菌自溶或死亡,避免污染菌过度生长掩盖致病菌,避免因标本存储不当而降低培养阳性率。
6.8.3 8.3 初次分离用培养基的选择及接种的技术要求
针对微生物检测项目和标本类型,应适当选择初次分离用的培养基种类,接种的技术要求见表6。
表6 不同送检项目和标本类型所需的培养基种类与接种的技术要求

表 6 不同送检项目和标本类型所需的培养基种类与接种的技术要求(续)

6.9 9 培养技术要求
6.9.1 9.1 微生物主要培养方式的技术要求
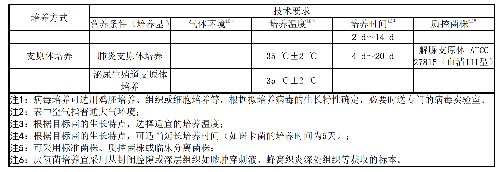
针对微生物的主要培养方式,技术要求(营养条件、气体环境、培养温度、培养时间等)见表7。
表7 微生物主要培养方式的技术要求注 1

表 7 微生物主要培养方式的技术要求注 1(续)
6.9.2 9.2 微生物定量培养技术要求
6.9.2.1 9.2.1 尿液定量培养的技术要求
a) 采用中段尿、膀胱穿刺尿、导管直接导出的尿液或夹住导尿管远端从导尿管穿刺出来的尿液进行定量培养,不可使用导管导出至尿袋中的尿液进行定量培养;
b) 采用血平板进行尿液定量培养;
c) 使用定量接种环取混匀但未离心的尿液标本时应见接种环内有尿液形成的薄膜;
d)接种环在血平板上不可重复划线,避免菌落重叠导致计数不准;
e) 接种好的平板放入含5%~10%的CO2孵箱,35 ℃±2 ℃培养24 h,观察并进行菌落计数。若无菌生长,应继续培养至48 h观察并计数,报告计数单位为每毫升菌落形成单位(Colony forming units per milliliter,CFU/mL)。
6.9.2.2 9.2.2 支气管肺泡灌洗液定量培养的技术要求
b) 将支气管肺泡灌洗液震荡混匀,用加样器或定量接种环进行接种,采用L型玻璃棒或接种环进行均匀涂布;
c) 将接种好的血平板和巧克力平板放入含5%~10% CO2的孵箱,35 ℃±2 ℃培养,24 h后,观察并进行菌落计数。若无菌生长,则继续培养至48 h或更长时间后观察并计数,报告计数单位为“CFU/mL”。
6.10 10 鉴定技术要求
6.10.1 10.1 微生物鉴定通用的技术要求
b) 尽可能将病原菌鉴定到种(或属),可采用一种或多种鉴定方法。若实验室不具备对特殊重要致病菌的鉴定能力,应将其送至有能力鉴定的实验室或所属的临床检验中心进一步鉴定;
c)当鉴定发现具有生物安全危害的病原菌时(如炭疽杆菌、O1群或O139型霍乱弧菌、布鲁杆菌等)应及时上报当地疾病控制中心进行确认;
d)对明确鉴定的、有临床意义的致病菌按照相关指南进行药物敏感试验(参见WS/T 639和WS/T 497)。
6.10.2 10.2 手工法鉴定的技术要求
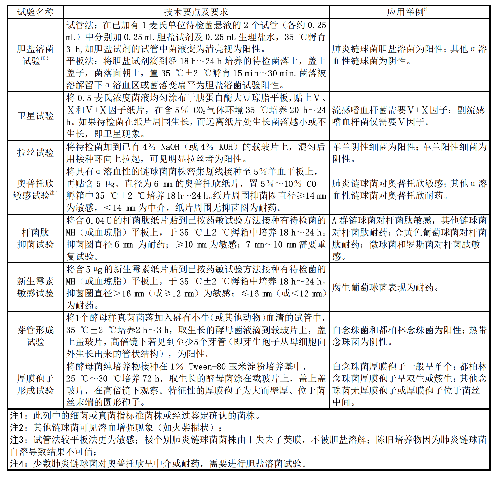
常用手工法鉴定试验的技术要点与要求见表8,开展手工法鉴定时应当注意:
b)根据菌落形态、革兰染色性、手工生化反应(如葡萄糖发酵、氧化酶、触酶等)试验将待测细菌初步分类;
c)进行生化鉴定试验时,应挑取纯菌落,进行触酶试验时,不要取到血平板上的琼脂,进行氧化酶试验时,不要用在含有染料的培养基(如麦康凯平板、中国蓝平板)上或含有葡萄糖的培养基上生长的菌落;
d) 注意培养时间对鉴定试验结果的影响。如芽管试验因孵育时间超过3 h,非白念珠菌会出现假阳性;
表8 常用手工法鉴定试验的技术要点、要求和应用范围
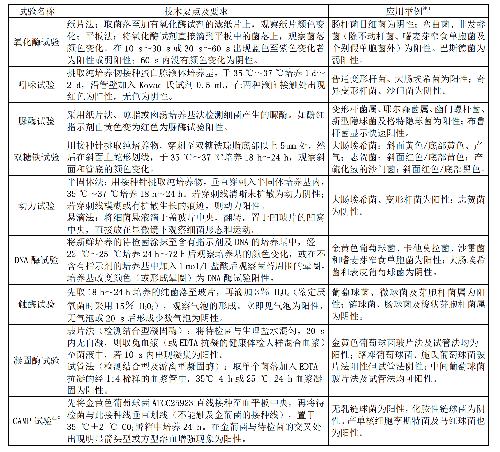
表 8 常用手工法鉴定试验的技术要点、要求和应用范围(续)
6.10.3 10.3 微生物分析仪鉴定的技术要求
a) 根据手工法初步分类选择相应的鉴定卡,切忌不进行初步分类直接使用鉴定卡进行鉴定;
b) 仪器提示需增加补充试验时,应按要求增加相应试验;
c) 每一批鉴定卡应按要求进行质控,使用前检查包装是否有破损,是否在有效期内;
d) 根据制造商对于鉴定数据库的更新要求,定时更新微生物鉴定系统的数据库。
6.10.4 10.4 质谱仪器法鉴定的技术要求
a) 待鉴定菌的培养时间应足够,以满足其达到所需的量和菌株生长状态的要求;
c) 靶板涂抹应均匀且厚度适中;
d) 不同的样本应使用不同的基质和配制溶剂,应避免基质液被污染,基质液应加适当量,并与样本形成均匀共结晶;
e) 应知晓所用质谱系统数据库能够覆盖的菌属种类及局限性,能够识别并采取措施避免质谱仪可能出现的错误鉴定。如将志贺菌属错误鉴定为大肠埃希菌,将肺炎链球菌错误鉴定为缓症链球菌群,将多糖奈瑟菌错误鉴定为脑膜炎奈瑟菌。
6.10.5 10.5 血清凝集法鉴定的技术要求
c) 当生化反应结果与多价血清凝集试验结果不一致时,应考虑特殊表面抗原的存在。如生化反应符合沙门菌,但A-F多价血清不凝集,应考虑是否存在Vi抗原;又如生化反应符合志贺菌,而与4种多价血清不凝集,应考虑K抗原存在。可将新制成的菌悬液放入沸水浴中加热15 min~30 min,冷却后再次做凝集试验;
d) 注意商品化血清试剂盒的局限性。若不能分型,需要用其他血清试剂盒或其他方法来分型。
6.11 11 分子检测技术要求
微生物分子诊断包括以核酸扩增为核心的荧光定量PCR、巢式PCR、多重PCR、逆转录PCR、数字PCR、等温扩增检测,以核酸杂交为核心的基因芯片检测,以及以测序为核心的扩增子测序、宏基因组测序、全基因组测序检测等。不需要单独进行核酸提取的快速即时检测技术能做到样本进、结果出,已应用于微生物检测。用于微生物分子检测的技术类型和特点见表9。分子诊断技术因其高灵敏性的特点,需要特别注意避免污染。主要的技术要求有:
a) 基因扩增实验室需要进行严格的物理分隔,设置不同工作区。各区所用的器材(如移液器和吸头)不可混用。工作流程和空气流向按照单一方向进行(如试剂贮存和准备区→样品制备区→扩增区→扩增产物分析区);如使用全自动扩增检测仪,区域可适当合并;
b)用于分子检测的标本宜单独送检,并注意避免污染。不能及时进行检测的标本需要进行适当保存;
c) 对提取的核酸,宜采取适当的方法确认核酸片段的完整性、核酸的产率及核酸的纯度;
e) 工作结束后应立即对工作区进行清洁,必要时进行消毒及去污染;

6.12 12 免疫学检测技术要求
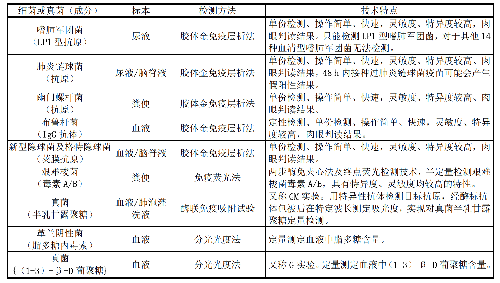
针对不同微生物,采取的免疫学检测方法各异。如胶体金免疫层析法检测嗜肺军团菌(抗原)、肺炎链球菌(抗原)、幽门螺杆菌(抗原)、布鲁杆菌(抗体)及隐球菌(抗原),免疫荧光法检测艰难梭菌(毒素),酶联免疫吸附试验检测真菌(半乳甘露聚糖),分光光度法检测革兰阴性菌(脂多糖内毒素)及真菌{(1-3)-β-D 葡聚糖}等。各免疫学方法的检测敏感性与技术特点有所不同。主要技术要求包括:
c) 分析可能影响结果的因素及临床意义;
e) 根据所用试剂的检测能力,进行定性或定量结果报告。针对细菌及真菌(成分),目前临床微生物实验室进行免疫学检测的标本类型、检测方法和技术特点见表10。
表10 针对细菌及真菌进行微生物免疫学检测的标本类型、检测方法及技术特点
6.13 13 质量保证
6.13.1 13.1 质量管理通用的技术要求
a)临床微生物检验人员、设备、设施、试剂、耗材、环境等的质量和数量应符合相关规定,满足所提供服务的需要。PCR实验室需通过资质认证。实验室应进行相应的性能验证及质量控制,并保存记录;
b)实验室应遵循法规以及行业标准、规范、指南;制定包括检验前、中、后全过程的标准化操作规程,定期审核、修订实验方法,并让员工易于获得;
c)应定期进行人员能力评估。由多名专业人员实施的手工检验项目应定期进行人员能力比对;
d)制定质量改进目标,如血培养标本质量改进目标。
6.13.2 13.2 微生物检验过程质量保证的技术要求
6.13.2.1 13.2.1 检验前的技术要求
6.13.2.1.1 13.2.1.1 标本选择、采集、储存和运送
d)制定并提供规范的申请单。
6.13.2.1.2 13.2.1.2 标本接收
实验室应制定标本接收和拒收标准。拒收时立即反馈,以便必要时重新采集。
6.13.2.1.3 13.2.1.3 周转时间
应告知临床医生标本到达实验室至发出报告的时间。
6.13.2.2 13.2.2 检验中的技术要求
6.13.2.2.1 13.2.2.1 标本质量评估
实验室应评估标本质量,退检不合格标本。特殊情况需要检测不合格标本时,应在报告单中说明。
6.13.2.2.2 13.2.2.2 检验方法
a) 未经修改的已确认的检验方法(也称为检验程序,已确认的检验方法包括经国家卫生管理部门批准的体外诊断医疗器械使用说明书中的方法,或国家、地区法规规定的方法,或公认的标准、文献中的方法)在性能验证满足要求后,可用于患者标本检测;
b) 经修改的已确认的检验方法或实验室自建方法,在性能确认满足要求后,方可用于患者标本检测。
6.13.2.2.3 13.2.2.3 结果准确性评价
a) 通过参加室间质量评价或实验室间比对活动评价检验结果的准确性。不能进行室间质量评价或实验室间比对时应通过临床评估来评价检验结果的准确性。实验室应保留原始记录和结果;
b) 检验结果准确性评价应由从事常规工作的人员使用与患者标本相同的检验方法进行。不可与其他实验室核对开展能力验证的检测结果。
6.13.2.3 13.2.3 检验后的技术要求
6.13.2.3.1 13.2.3.1 结果报告
a)结果报告内容应与检验目的一致;
b)按确定的“危急值”清单,及时报告危急值结果,保留报告记录;
c)宜将药敏试验结果分组选择性报告;
d)应向临床提供联系方式以便其对可疑结果进行确认,并进行相关咨询。
6.13.2.3.2 13.2.3.2 菌种保存
6.13.2.3.3 13.2.3.3 标本保存与废弃处置
7 参考文献
[1] 国家市场监督管理总局、中国国家标准化管理委员会.医学实验室 质量和能力的要求 第1部分:通用要求:GB/T 22576.1-2018.2018.
[2] 国家市场监督管理总局、国家标准化管理委员会.医学实验室 质量和能力的要求 第 6 部分:临床微生物学检验领域的要求:GB/T 22576.6-2021.2021.
[3] 中华人民共和国国家卫生和计划生育委员会医政医管局.全国临床检验操作规程(第四版).北京:人民卫生出版社,2015.
[4] World Health Organization (WHO). Diagnostic stewardship: a guide to implementation in antimicrobial resistance surveillance sites, 2016.
[5] Clinical Laboratory Standards Institute (CLSI). Principles and Procedures for Detection of Fungi in Clinical Specimens - Direct Examination and Culture; Approved Guideline, M54, 2012.
[6] 中华人民共和国国家卫生和计划生育委员会.肺结核诊断:WS 288-2017.2017.
[7] 中华人民共和国国家卫生和计划生育委员会.下呼吸道感染细菌培养操作指南:WS/T 499-2017.2017.
[8] 中华人民共和国国家卫生和计划生育委员会.尿路感染临床微生物实验室诊断:WS/T 489-2016.2016.
[9] 中华人民共和国卫生部.医疗机构消毒技术规范:WS/T 367-2012.2012.
[10] 中国医师协会检验医师分会儿科疾病检验医学专家委员会.儿童血培养规范化标本采集的中国专家共识.中华检验医学杂志,2020,43(5):547-552.
[11] 胡继红,马筱玲,王辉,等.MALDI-TOF MS在临床微生物鉴定中的标准化操作专家共识.中华检验医学杂志,2019,42(4):241-249.
[12] American Society of Microbiology (ASM). Clinical Microbiology Procedures Handbook, Washingtong DC, 2016.
[13] 王辉,马筱玲,钱渊,等.临床微生物学手册(第12版).北京:中华医学电子音像出版社,2021.
[14] 沈定霞.医学重要真菌鉴定指南(第五版).北京:中华医学电子音像出版社,2016.
[15] 王辉,任健康,王明贵.临床微生物学检验,北京:人民卫生出版社,2015.